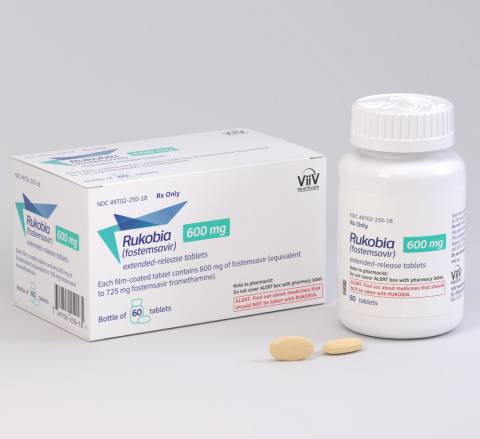
2020年7月2日美国食品药品监督管理局批准了Rukobia(fostemsavir),这是一种新型抗逆转录病毒药物,适用于曾尝试过多种HIV药物且由于耐药,不耐受或出于安全考虑而无法成功通过其他疗法治疗的HIV感染者。
FDA药物评估和研究中心抗病毒药物部门副主任Jeff Murray医师表示:“ 新型抗逆转录病毒药物的上市对于经历过大量治疗且具有多重耐药性HIV感染的患者至关重要,它可以帮助处于HIV合并症风险较高的难以治疗的HIV患者更长寿,更健康的生活。”
HIV被认为是一种可控的终生疾病。然而,由于耐药治疗失败的多重耐药成人患者有AIDS病情进展,甚至面对死亡的风险,该群体患者迫切需要新的治疗方案。
该研究共有371名受试者参与Rukobia每天口服两次的安全性和有效性,这些成年参与者尽管正在服用抗逆转录病毒药物,但血液中仍然含有高水平的病毒(HIV-RNA)。
在主要试验组中治疗了272名参与者,另有99名参与者在另一试验组中接受了Rukobia。 大多数参与者已经接受了超过15年的HIV治疗(71%),在进入试验之前已经接受了五种或更多种不同的HIV治疗方案(85%)和/或有艾滋病病史(86%)。
根据随机队列中从第1天到第8天与服用安慰剂的受试者相比,用Rukobia治疗的受试者在第八天的血液中HIV-RNA的更大明显下降。
第八天之后,所有参与者都接受了Rukobia以及其他抗逆转录病毒药物。试验结果表明,经过24周Rukobia加其他抗逆转录病毒药物的治疗后,53%的参与者血液中HIV的RNA水平低到被认为检测不到。96周后,60%的参与者HIV的RNA水平实现病毒抑制。 服用Rukobia 最常见的不良反应是恶心。 严重的不良反应包括也感染了乙型或丙型肝炎病毒的参与者的肝酶升高,以及免疫系统的变化(免疫重建综合症)。
Rukobia(fostemsavir)1瓶60片/600毫克在美国的价格大约为(目前未知)美元。
FDA将Rukobia批准给ViiV Healthcare。

(原创)美国希望之光医疗编译,欢迎转载,请注明出处。
全球顶级医生协会(Global Top Doctors Association)是美国加州政府正式注册的联邦政府批准的一个非营利性,非宗教,非政治性国际社会组织,总部位于洛杉矶。全球顶级医生协会为中西方医学和精神专业人士的科学研究创造更有利的环境,为他们提供机会在社区,全国以及全球服务人群,满足民众的身体与精神健康需求。

